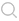【导读】随着器官芯片技术的发展,其应用仍然存在一定的局限性,大部分生理途径需要连续介质循环和组织间相互作用,单器官芯片无法全面反映机体器官功能的复杂性、功能变化和完整性。
随着器官芯片技术的发展,其应用仍然存在一定的局限性,大部分生理途径需要连续介质循环和组织间相互作用,单器官芯片无法全面反映机体器官功能的复杂性、功能变化和完整性。为适应人体结构复杂性,未来的研究需要建立更加复杂的多器官微流控芯片(Multi-Organ-Chip, MOC)系统,将几种器官等同物合并到类似人类的代谢环境中,开发动态的实验室微生物反应器,进行系统的毒性检测和代谢评估。
微流控芯片技术(Microfluidics)也被称为芯片实验室(Lab-On-a-Chip, LOC),涉及物理、化学、医学、流体、电子、材料、机械等多学科交叉的研究领域。通过微通道、反应室和其他某些功能部件,对流体进行精准操控,对生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成分析,具有液体流动可控、集成化、消耗低、通量高、分析快等优点,已经被广泛应用于生物医学和环境科学等研究领域。基于微流控芯片技术的人体器官芯片(Human organs-on-chips)近几年来发展迅速,已经实现肺、肾、肠、肝、心脏、血管、皮肤、大脑、骨骼、乳腺、脾脏、血脑屏障、气血屏障等芯片的构建,通过与细胞生物学、工程学和生物材料等多种学科的方法相结合,体外模拟多种活体细胞、组织器官微环境,反映人体组织器官的主要结构和功能特征。
人体不同器官或整个系统的毒性检测是药代动力学和药效学研究的重要部分,传统的二维细胞培养模式以及动物实验取得了诸多成就,但受周期、成本、精准度、伦理等因素的限制,难以预测人体对于各种药物的响应。研究表明:人体器官芯片技术能准确地控制多个系统参数,与传统的毒理学动物实验相比更能反映人体内真实情况,在新药筛选方面更具特异性。因此,利用微加工技术,建立更接近人体环境的仿生系统成为体外生理模型的研究热点。
然而,随着器官芯片技术的发展,其应用仍然存在一定的局限性,大部分生理途径需要连续介质循环和组织间相互作用,单器官芯片无法全面反映机体器官功能的复杂性、功能变化和完整性。为适应人体结构复杂性,未来的研究需要建立更加复杂的多器官微流控芯片(Multi-Organ-Chip, MOC)系统,将几种器官等同物合并到类似人类的代谢环境中,开发动态的实验室微生物反应器,进行系统的毒性检测和代谢评估。
本文综述了近年来多器官微流控芯片的研究进展,并对其发展趋势进行了展望。
多器官微流控芯片的设计原理
多器官微流控芯片将不同器官和组织的细胞在芯片上培养,以微通道相连,实现多器官集成化,以考察其相互作用或建立一个系统,用于体外药物筛选。芯片中可集成数个经过特殊设计的微培养室、灌注通道并同时培养多种细胞,利用微流控技术可以产生精确可控的流体剪切力、周期性变化的机械力和溶质浓度梯度变化的灌注液。利用这些平台优势,多器官微流控芯片可以用于细致地分析组织、器官特异性应激反应,例如循环免疫细胞的募集、对药物、毒素或其他刺激因素的应答等。除此之外,将多个模拟不同器官、组织的芯片,按照体内的关系,用血管内皮组织、血细胞或是流体介质将其连接起来,就能在体外模仿体内不同器官、组织之间的生理作用和药物分布等。
图1所示为 MOC系统装置,图1(a)包括两个聚碳酸酯盖板,PDMS-玻璃芯片用于承载血流回路(粉红色)和排泄流动回路(黄色);数字分别代表肠道(1),肝脏(2),皮肤(3)和肾脏(4)组织的4个组织培养隔室。多器官芯片布局的顶视图示出了血液回路中的3个测量点(A,B和 C)的位置以及排泄回路中的两个测量点(D,E)。该装置用微泵设备来控制流体的顺时针和逆时针流动,以微通道相连接,在芯片上培养构建了可容纳肠、肝、皮肤、肾4个器官的MOC系统,通过两个流动回路模拟模拟药物在肠内吸收、肝脏代谢以及肾脏排泄,用于体外检测候选药物安全性和有效性评估。应用该系统体外模拟了人体内葡萄糖代谢的环境,结果显示芯片“口服”药物,吸收后药物通过模拟的血液循环,经过肝脏,然后进入皮肤和肾脏,到达肾脏器官模型代谢并经肾尿液排出,进一步验证了葡萄糖在小肠内的代谢途径。此外,还有相关研究共培养神经球和肝球体,构建神经系统-肝脏多器官微流控芯片,用2,5-己二酮研究其对组织的毒性作用和代谢途径,通过测定葡萄糖消耗量和乳酸产量作为MOC系统代谢活动的指标。在肝中,正己烷可能以解毒途径或者生物活化途径代谢为己醇,经过血液到达大脑产生毒害作用,实验中对两种不同浓度的2,5-己二酮的毒性测定结果表明其诱导了神经球和肝微组织中的高度细胞凋亡。
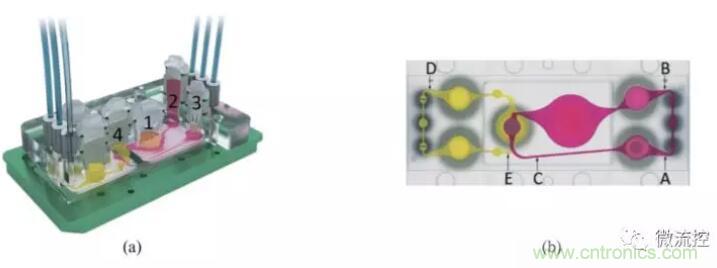
图1 多器官微流控芯片设计示意图
多器官微流控芯片系统研究
微细胞培养物类似物(μCCA)与PBPK模型
药代动力学模型(Physiologically Based Pharmacokinetics, PBPK)是指一种更符合药物在体内动态变化的具体状况的模型,对于新药研发具有重要作用。PBPK模型以“生理学室”代替经典模型中的隔室(房室模型),根据质量平衡关系、按模型建立速度方程、对方程组进行求解、得出各个组织或器官的毒物浓度与时间的关系,可基本明确药物在体内动态增加或减少的实际情况。由于微流体可以精确控制多个隔室的流动和连接,区域化的微流体系统可以作为PBPK模型的体外平台。
经过对多器官微流控芯片系统的研究,开发了一种模拟人类对药物反应的高通量体外系统,将基于微流控芯片的微细胞培养物类似物(Microscale Cell Culture Analog, μCCA)与PBPK模型结合使用,建立对应PBPK数学模型的物理装置(μCCA装置)。在装置中,每个器官代表一个隔室,代表关键器官的腔室被制造在硅芯片上,并通过微通道相互连接用于模拟血液流动中的介质再循环,μCCAs缩小器件可以在体外模拟近生理流体流动条件、体内组织的尺寸比以及多组织器官的相互作用,通过使用外部泵和外部常见的介质再循环来支持个体肝脏、骨髓和肿瘤细胞系培养隔室之间的相互作用。在对肝脏、骨髓和肿瘤细胞系共培养研究中,根据人类组织数据设置缩放细胞室及相关参数,μCCA装置中不同组织或者器官分别以单独的隔室相连接来模拟多组织器官的作用环境。实验结果显示,μCCA装置能够捕获肝脏隔室中的代谢,可以观察到传统孔板测定中未观察到的肿瘤细胞的损伤。
结合PBPK预测的μCCA装置可以与人体试验的药物处理匹配,不仅能模拟动态的多器官相互作用,并且还能够模拟现实的生理微环境,实现体外研究药物的药代动力学等药效学性质。μCCA装置的微环境是基于一个简化的PBPK数学模型设计的,在研究药代动力学、不同器官细胞间互作及毒性和代谢相互作用的假设检验等方面有重要意义。不足的是,当细胞以流体连接的方式培养时,培养基在提供营养物质、去除细胞废物的同时,也可能会放大未知灌注液对隔室细胞的毒性作用。
多通道三维微流控细胞培养系统(3D-μFCCS)
由于μCCA装置的不足,要设计一个体内高度保守的系统,重要的是以流体联系的方式培养多种细胞类型,同时保持彼此间的隔离,据此开发了一种多通道3D微流控细胞培养系统(3D microfluidic Cell Culture System, 3D-μFCCS)。
3D-μFCCS是由多个微通道相互连接的微流体通道和微阵列组成,采用微阵列技术对多种细胞类型进行高密度物理固定,以获得最大的细胞-细胞相互作用。在3D球形微组织和微流控技术进行多组织实验分析中,将预先形成的球形微组织装载到微室中并在连续灌注下培养,通过自动化的芯片倾斜由重力驱动的流动产生,而不需要额外的管道和外部泵。以3D-μFCCS为基础构建的鼠肝和大肠肿瘤MOC系统在前体药物环磷酰胺存在下培养8d,仅在芯片上不同微量组织类型的共培养物中观察到对肿瘤生长有显著影响,而环磷酰胺处理的静态肝脏微组织的不连续转移上清液并不显著影响肿瘤生长。该系统验证了环磷酰胺对肿瘤生长有显著的影响,但在体外无抗肿瘤活性,只有在肝脏被生物活化之后才起作用。
此外,多通道3D-μFCCS还被设计用于同时培养不同器官的细胞聚集体以模拟身体中的多个器官。培养4种不同的细胞类型,以模拟人类的4种器官:C3A(肝脏),A549(肺脏),HK-2(肾脏)和 HPA(脂肪),通过补充常见的培养基与生长因子来优化细胞功能。在细胞培养过程中,特异性地将TGF-β1在A549室内控制释放,能增强A549细胞的功能,而C3A、HK-2和HPA细胞的功能不受影响,与模拟单个组织功能有所不同。3D-μFCCS装置上,细胞培养隔室之间有限的相互作用类似于体内的情况。
单向流动的生物测定系统及其他MOC系统
相比μCCA和3D-μFCCS,Imura及其同事构建的生物测定系统是相对先进的版本,它将人类的肠道,肝脏和乳腺癌细胞系培养物组合成一个单一的线性通道,应用单向流动而不需要介质再循环。微芯片由载玻片,透气膜和聚二甲基硅氧烷片组成,其中含有通过光刻制成的微通道。将Caco-2克隆结肠腺癌细胞在微芯片的膜上培养,模拟药物的体内肠转运:环磷酰胺能透过肠屏障的,表现出较高的渗透系数,环磷酰胺不能被肠壁吸收的,表现出较低的渗透系数。渗透测试结果与使用传统方法获得的结果一致,而电池消耗减少80%。
近年来,在原有器官芯片系统的基础上,MOC系统进一步发展完善。Loskill等利用μOrgano系统研究多个心脏单元,可以单独加载不同类型的细胞,控制分化和发育的时间,控制各个组织的流体连接,即插即用。Maschmeyer等设计了可容纳两个微生物流体流动回路的MOC装置,首次实现了肠、肝、皮肤和肾4个器官组织在微流控芯片上重复培养28d,且所有组织在整个共培养期间保持高细胞活力和离散的生理组织结构,成功从生理角度证明了肠道的功能以及肾脏的生物屏障。除了肠屏障与肾屏障,多器官微流控芯片还成功地模拟了人体的多个生物屏障,例如利用Transwell装置在悬浮于孔中的滤膜上培养细胞模拟血脑屏障进行药物转运研究及检测特定标志物的表达,在气液界面实现肺上皮细胞与血管内皮细胞共培养的气血屏障等。
多器官微流控芯片的设计及新应用
多器官微流控芯片设计
多器官微流控芯片的设计基于PBPK的理念,可利用模型预测人体对药物的反应以及药物的作用机制。最常制造的装置是尺寸在10~200mm之间的微流体通道,隔室的大小根据其功能正确地设计比例,不同的器官功能根据其机制的不同而具有不同的尺度。微流体系统材料通常采用聚二甲基硅氧烷,优化后多用多孔性较好的水凝胶,可允许水凝胶支架内的分子扩散。芯片制作后需要鉴定和测量培养的组织在用药物或工程刺激物处理时的功能反应,进行细胞活力、机械力、电信号检测以及化学分析等。
目前,设计微流控芯片体系主要使用PBPK模型和PD模型。在PBPK模型中,药代动力学 (Pharmacokinetics, PK)建模的方法用来设计和操作以再现多器官相互作用。PK建模可量化身体不同部位的药物量,可用简单的术语来描述药物给药后吸收、分布、代谢和消除的复杂过程,并深入了解药物分布动力学。然而,建立一个生理学上准确的模型是十分困难的,因此限制了PK建模的广泛使用。药效动力学(Pharmacodynamics, PD)建模中药理学作用被视为药物浓度的函数,是针对药物在体内的药理作用的研究模型。单独的PK模型不能阐明时间-药效的关系,单独的PD模型也不能阐明时间-浓度的关系,因此需要结合两者建立PK-PD模型以研究药物作用靶部位的浓度-效应-时间三维关系。在PBPK-PD模型中,PD模型与PK 模型耦合,使用组合的PK-PD模型来预测或分析给定剂量药物的生理效应,综合PK-PD模型可以评估特定剂量下药物的生理结果的时间依赖性变化,应用性相对较广泛。
多器官微流控芯片的新应用
随着多器官微流控芯片在药物代谢方面应用研究的深入,也产生了各种新应用,如利用肺器官芯片研究纳米材料毒性及代谢。哈佛大学通过研究肺对荧光纳米颗粒传递至肺上皮细胞引发的一系列毒性反应,来探究应用于环境毒理学的肺芯片系统的潜在价值,为环境污染物的体内代谢模拟研究开拓了新的视野。
与大气污染物有关的癌症病例中,细颗粒物PM2.5起至关重要的作用,PM2.5可以穿透人体肺屏障并进入血液系统引发各种疾病甚至癌症。但其在体内的代谢途径和致癌作用机理尚不明确。而目前研发的应用于药代动力学和药效学方面的多器官微流控芯片系统为该类研究提供了新的技术上的可能。为研究大气污染与疾病发生,目前研发的肺上芯片系统已经能够测试空气中的微粒和物质对单层细胞或三维细胞聚集体的毒性。基于微流控技术评估空气质量对人类健康的影响,利用器官芯片模拟健康和病态肺的功能,对空气传播的污染物暴露对呼吸系统的短期和长期影响进行无动物测试。与口服药的代谢途径不同,颗粒物在体内的代谢途径主要有两种:一是经皮肤入血,经由心入肺再进入体循环分配到肝和肾;二是经肺泡入血进入体循环分配到肝和肾。而未知浓度的真实大气颗粒物样品进入体内的分布和代谢由于难以监测,无法确定其浓度,因此缺乏相应的数学模型来进行后续的研究和预测,目前多是采用荧光标记的人造颗粒物来进行模拟。因此在肺芯片相关毒性研究的基础上,设计合理的真实反应颗粒物体内代谢的多器官微流控芯片系统,建立完整的模拟颗粒物代谢的体外平台、精准确定颗粒物代谢途径、制定精确的代谢模型并进一步揭示颗粒物的致癌机理是亟待进一步深入研究的重要科学问题。
此外,微芯片制造通过微电子机械系统(Microelectromechanical systems, MSMS)与芯片实验室和器官微流控芯片系统相结合,MEMS允许将几种微小或纳米微传感器、致动器、加速度计、热控制器、微流体推进器、微波设备、卫星通信等的各种组件最小化,可用于卫星等航天技术,也可用于监测沙尘暴或火山活动等产生的污染源。
展望
微流控技术由微加工技术与三维培养相结合产生,在体外细胞培养中潜力较高。多器官微流控芯片技术可在微尺度对流体精准控制,模拟人体生理环境,克服了传统二维细胞培养模式与动物实验的不足,具有高度仿生性。MOC系统的发展结合了工程技术的优点,可调整流体流动和微通道中可控的局部组织-流体比率。MOC技术旨在建立人工的仿生环境,在器官-组织水平上模拟,以研究不同器官细胞之间的相互作用、相关生理代谢途径以及生理毒性检测等。
人体芯片(Human-on-a-chip)是一种利用微加工技术,基于MOC系统将多个器官微流控芯片连用反映人体整体系统的仿真体系。自2011年NIH、FDA和国防部人体芯片专项设立以来,全世界范围内掀起了人体芯片的研究热潮。Human-on-a-chip旨在通过动态控制细胞微环境的各种培养条件,在微流控芯片上模拟人类多个器官主要功能,从而达到复原芯片上的“人体”系统。相较于单器官芯片,人体芯片更能全面反映机体器官功能的复杂性、功能变化和完整性,并且应用性更强。
目前,基于MOC系统的发展和完善,已经实现了体外模拟心脏、生物血管、肺癌细胞转移、 肠道功能和肾脏生物屏障等环境。虽然MOC克服了传统二维细胞和动物实验的诸多不足,但是也面临芯片设计上器官的缩放、高通量分析、芯片上的检测分析、疾病模型和细胞来源等问题,在实验中涉及到的长期的动态营养平衡、器官的细胞和组织稳态、毒性检测的完整性、检测方法的特异性和灵敏度、芯片的材料等依旧是MOC系统亟待解决和完善的。此外,MOC在生物学研究、医学、毒性测试、药物代谢等领域应用比较多,但在进入体内的污染物比如颗粒物PM2.5对人体的毒害及体内代谢方面研究极少。相信随着技术的发展和研究的深入,MOC系统将广泛应用于医学、药学、生命科学等领域,我们离‘Human-on-a-chip’的实现亦越来越近。